重大突破!卵巢衰老元凶找到了
发布于:2025/8/25

随着生育高龄化,调查数据显示我国不孕不育发病率已经上升到16-18%,且有继续上升的趋势。
在不孕不育研究中,最让人绝望的就是卵巢出问题,最典型的就是卵巢功能衰退,尤其是过早衰退,这对生娃来说就像是遭遇无源之水。

卵巢这个掌管女性生育和青春荷尔蒙的器官是我们身体里老的最快的器官,常常比皮肤松弛、头发花白来的更早更隐蔽,直接影响生育力和整体健康。
随着抗衰医学的发展,我们已经知道氧化压力是各种衰老的幕后推手,卵巢早衰更不例外,因为卵巢是氧化最先影响的一个器官。
但它背后的机制是什么?靠什么能逆转?一直是个谜。但这个谜现在或许已经被破解,让我们一起来看看吧!
1、最新研究揭示:NCOA7与卵巢衰老有关
2025 年 7 月 31 日,山东大学妇儿与生殖健康研究院陈子江/秦莹莹/焦雪团队联合山东大学药学院娄红祥/董婷团队合作,在 Nature Aging 期刊发表了研究论文。
首次揭示了 NCOA7 通过介导应激颗粒(SG)的自噬清除过程,参与调控卵巢衰老,描绘了卵巢对应激压力的适应机制,并为缓解卵巢衰老、改善生育力的治疗策略提供了潜在新靶点。

本研究发现,早发性卵巢功能不全患者及生理性卵巢衰老女性颗粒细胞存在明显细胞衰老表型。
进一步研究发现,衰老卵巢在长期氧化应激压力下,颗粒细胞中NCOA7表达水平显著下调且呈现异常定位。更为关键的是,NCOA7的表达水平与细胞衰老及卵巢功能指标呈现相关性。

(衰老卵巢颗粒细胞NCOA7表达降低)
此外,在团队前期已建立的上千例POI女性全外显子组测序(POI-WES)数据库中发现了致病性NCOA7突变,突变导致蛋白稳定性降低,加重颗粒细胞衰老表型。
通过构建NCOA7敲除的颗粒细胞系、全敲及颗粒细胞条件性敲除小鼠模型,证明NCOA7缺失促进颗粒细胞衰老及卵巢衰老。
机制研究发现,NCOA7具有液-液相分离(LLPS)特性,其LysM结构域可与SG核心蛋白G3BP1的NTF2L结构域发生特异性相互作用,进而介导SG的自噬清除。
NCOA7缺失时,颗粒细胞内SG清除出现障碍,导致异常积累,进而加速细胞衰老进程。
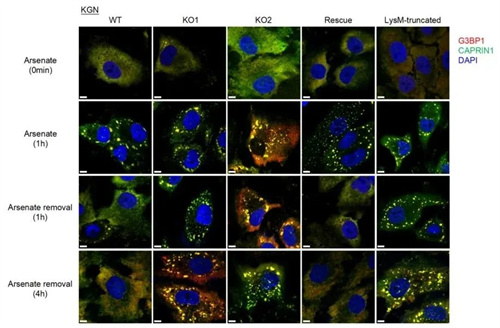
(NCOA7缺陷影响细胞SG清除)
2、为什么“维修队长”NCOA7会失灵?
研究者在卵巢早衰病人中发现了NCOA7 基因的“损坏”(突变)。
有的突变直接把指令书截断(无义突变),造不出完整队长;有的突变让队长的关键钩子(LysM)或拖车连接器(TLDc)变形松动(错义突变),抓不牢桩子或拖车。
即使基因没坏,在自然衰老的卵巢里或者长期高压(慢性氧化应激)环境下,卵巢“工厂”也不太生产NCOA7 队长了(表达下调)。
原因可能包括信号指令出问题(表观遗传修饰改变)和高压抑制了生产。
以上这两种情况几乎涵盖了九成卵巢出问题的情况,都和NCOA7有关。
NCOA7 坏了或少了,就无法把“应急帐篷”(SG)挂到“垃圾回收拖车”(自噬)上。
压力过去后,帐篷拆不掉,堆积如山(SG异常积累),这会导致颗粒细胞变成“僵尸”。
一句话总结就是,卵泡变少(卵子仓库空虚),卵巢组织长“疤”(纤维化),最终导致卵巢功能衰竭(衰老)——难怀孕、激素失调、提前绝经。
面对这种情况,研究者想出了两个办法:一个是让现有的“回收系统”加班,也就是激活自噬;另一个是派遣“新队长”支援(补充NCOA7)。具体来说,就是:
•使用自噬激活剂雷帕霉素促进SG自噬清除,可显著改善NCOA7缺陷模型中的衰老表型,为雷帕霉素延缓衰老的机制提供全新视角;
•研发脂质纳米颗粒递送NCOA7 mRNA,提升细胞NCOA7表达,成功实现了颗粒细胞功能的恢复,开发了极具潜力的卵巢衰老治疗策略。
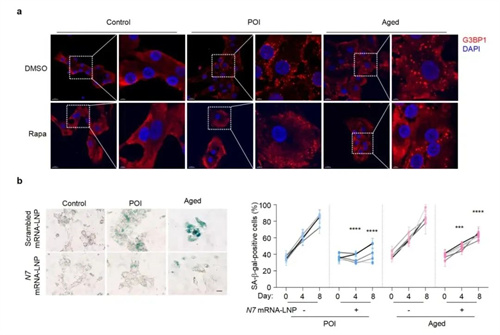
(靶向NCOA7-SG通路进行衰老挽救)
总的来说,这些发现不仅阐明了NCOA7-SG轴在衰老中的关键调控作用,更为卵巢衰老精准诊疗策略提供了实验依据。
也许今天的我们还无法让卵巢重返20岁,但每一次研究的突破,都在为未来埋下希望的种子。
希望不久的将来,这项研究能够快速应用于临床,让广大女性不惧时间,不惧未来,让求子的姐妹都能如愿抱娃!

国外试管婴儿服务
LOVE & FAMILY
让你实现做父母的梦想
圆梦热线: 4008-257-611



























